Commerce parallèle de médicaments vétérinaires
Le commerce parallèle est une procédure administrative qui permet de se procurer dans un autre état membre de l’Espace économique européen, dans de meilleures conditions économiques, un médicament vétérinaire ayant une origine commune avec un médicament vétérinaire autorisé en France. La demande peut être déposée par un distributeur en gros de médicaments vétérinaires.
Les médicaments vétérinaires objets du commerce parallèle font l’objet d’un ré-étiquetage en langue française avant d’être commercialisés en France.
Cette procédure ne remet pas en cause les conditions de prescription et de délivrance au détail applicables en France.
L’article 102 du règlement prévoit qu’en cas de commerce parallèle, le distributeur en gros doit s’assurer que le médicament vétérinaire qu’il souhaite se procurer dans un autre Etat membre partage une origine commune avec le médicament vétérinaire autorisé dans l’Etat membre de destination.
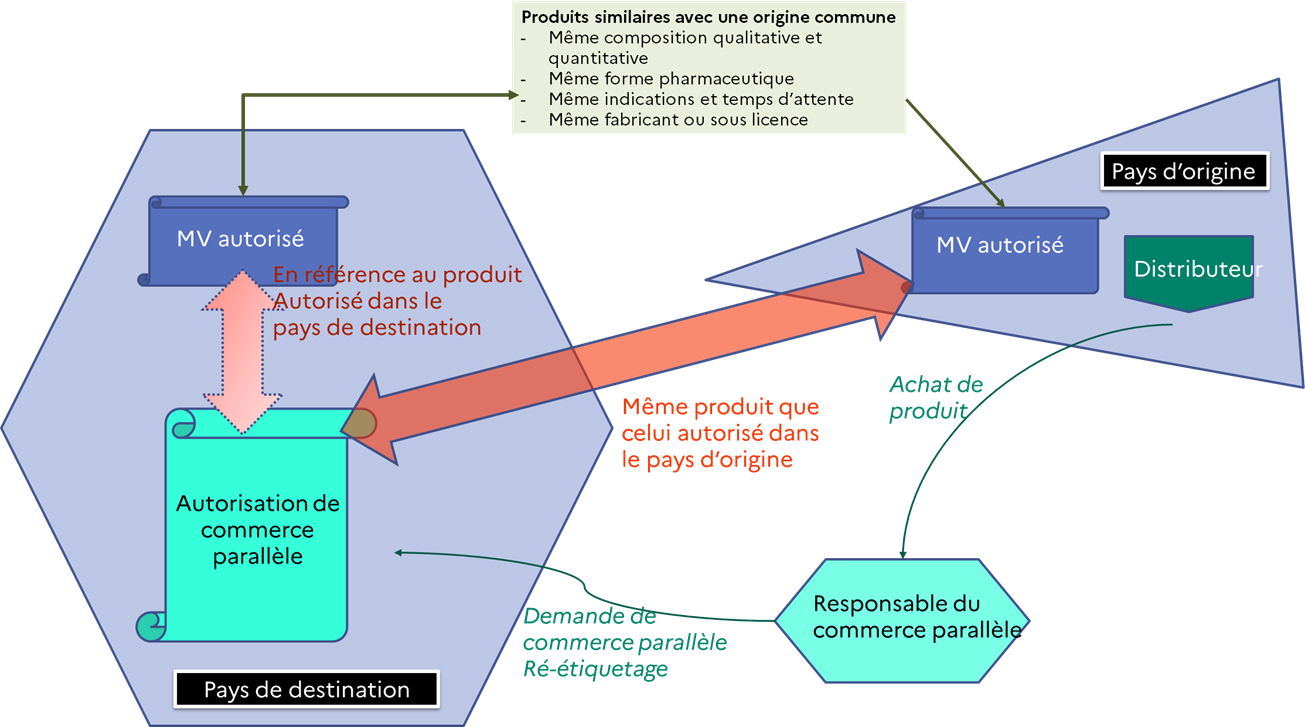
Les autorités compétentes mettent en place des procédures administratives applicables au commerce parallèle des médicaments vétérinaires et une procédure administrative pour l’approbation des demandes de commerce parallèle.
Le distributeur en gros qui a l’intention de procéder au commerce parallèle d’un médicament vétérinaire doit présenter une déclaration à l’autorité compétente de l’Etat membre de destination.